清华新闻网4月28日电 基因表达水平的精确调控对细胞的正常功能至关重要。细胞内的基因表达可能是静止的、剧烈的,或是柔和的。如果把基因的表达水平比作我们熟悉的水温,那么静止或剧烈的基因表达状态就像冰水或沸水,而柔和的基因表达则更像是适宜的温水。在干细胞中,约有30%的基因处于这种温和的表达状态,这些基因包含维持干细胞特性的关键基因。然而,这些基因的表达是如何得以“保温”的,目前仍不十分清楚。
传统上,人们认为基因表达水平受到转录因子、转录辅助蛋白、染色质的可及性以及RNA聚合酶II在启动子区域的聚集等多种因素的影响。最新研究表明,转录相关蛋白通过相分离能形成转录凝聚体,这在转录调控中扮演重要角色。然而,由于难以在基因组范围内精确定位和识别这些转录凝聚体,特别是对于在非超级增强子区域的转录调控,人们对这些凝聚体与转录调控之间的联系知之甚少。
近期,太阳集团tyc5997药学院李寅青课题组与生命学院李丕龙课题组研究开发了一种名为Assay for Chromatin-bound Condensates by exploratory Sequencing(ACC-Seq)的全基因组范围内检测凝聚体分布的技术。通过ACC-Seq,研究人员鉴定了一类独特的双效应转录因子(dual-action TFs)。这类转录因子通过形成转录凝聚体,能在抑制基因高表达的同时激活沉默状态的基因,从而将基因表达水平“保温”在特定的活化程度。
ACC-Seq技术是基于以下原理:在基因组中,那些没有凝聚体结合的区域,即使经过1,6-己二醇处理,其染色质可及性(由ATAC-seq评估)也基本保持稳定。然而,在凝聚体结合的区域,由于1,6-己二醇破坏了凝聚体,染色质的可及性会发生变化。通过对这些变化进行对比分析,能够识别出基因组中哪些位置被转录凝聚体占据。
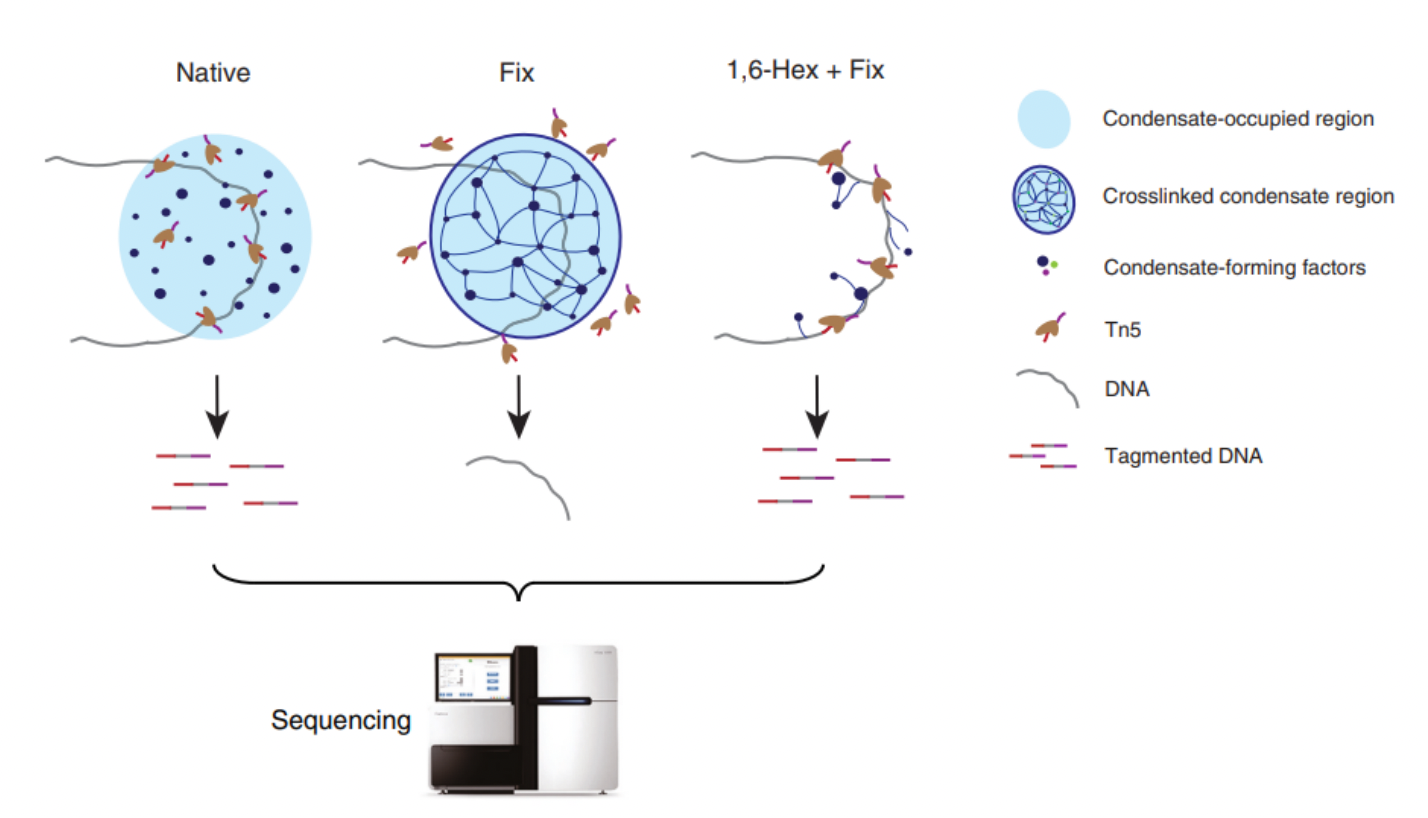
图1. ACC-Seq的设计原理
通过运用ACC-Seq技术,研究者们在小鼠胚胎干细胞(mESC)中识别出了一组具有相分离能力的转录因子,这些转录因子被称为双效转录因子(dual-action TFs),其中包括ETV5等。值得注意的是,当这些dual-action TFs发生相分离时,它们虽然与转录的核心组分RNA聚合酶II(Pol II)有一定的亲和性,但与其他活化组分如MED1之间则可以表现出较低的亲和性。深入的研究揭示,这种差异性的亲和性使得dual-action TFs在调控基因表达上具有双效的调控功能:在高表达基因处,它们起到抑制作用;而在沉默的基因区域,则能激活这些基因。
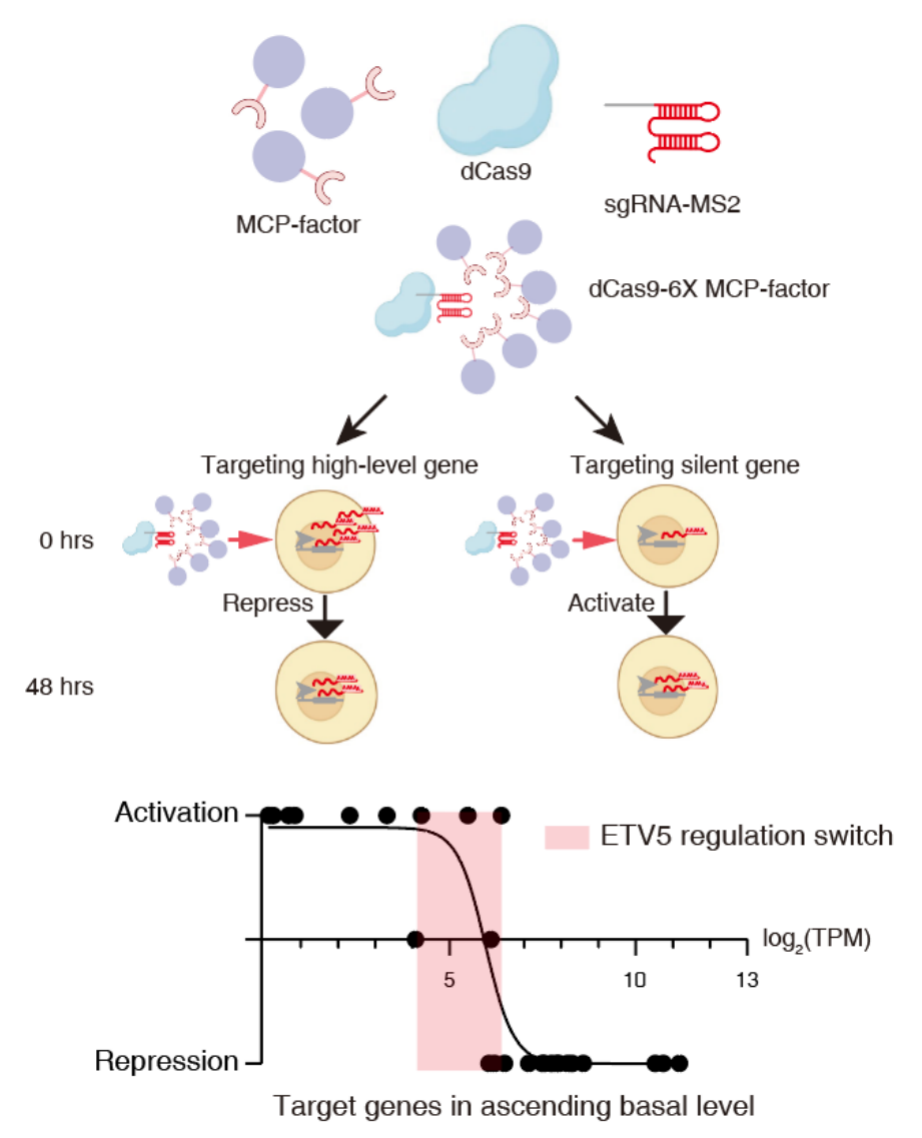
图2.dual-action TFs进行双效转录调控
进一步研究发现,这些dual-action TFs与传统的通过招募不同辅助因子实现转录调控的bifunctional TFs有所不同,也与常见的激活或抑制因子有所区别。此外,研究人员还确认这些dual-action TFs并不是通过介导如H3K9me3等表观遗传修饰来调控转录的。
过去的研究曾提出,凝聚体可以作为一种机制来缓冲其组份浓度的波动。基于这一理论,研究团队推测dual-action TFs可能通过形成转录凝聚体减少转录过程中的波动。研究团队使用报告基因系统深入探究了dual-action TFs的转录调控特性。实验结果表明,与对照组相比,dual-action TFs能够显著稳定转录水平。
然后,研究者进一步确认dual-action TFs的双效转录功能与其相分离能力密切相关。破坏它们的无序区序列(IDR)会导致它们在凝聚体中与MED1的亲和性改变,并失去双效转录调控能力。而将dual-action TFs与亲水的MBP肽段融合,使这些蛋白的相分离能力受到干扰,双效转录调控功能也会受到显著影响。研究者还发现,与疾病相关联的某些突变可以改变dual-action TFs在凝聚体中的亲和性,并扰乱其双效转录调控能力。
最后,研究还表明,当这些dual-action TFs在小鼠胚胎干细胞中被敲低后,干细胞脱离干性状态。相反,当过表达这些dual-action TFs时,干细胞状态维持相关基因的表达水平略有上升,从而进一步证实了dual-action TFs在小鼠胚胎干细胞功能维持中的关键作用。
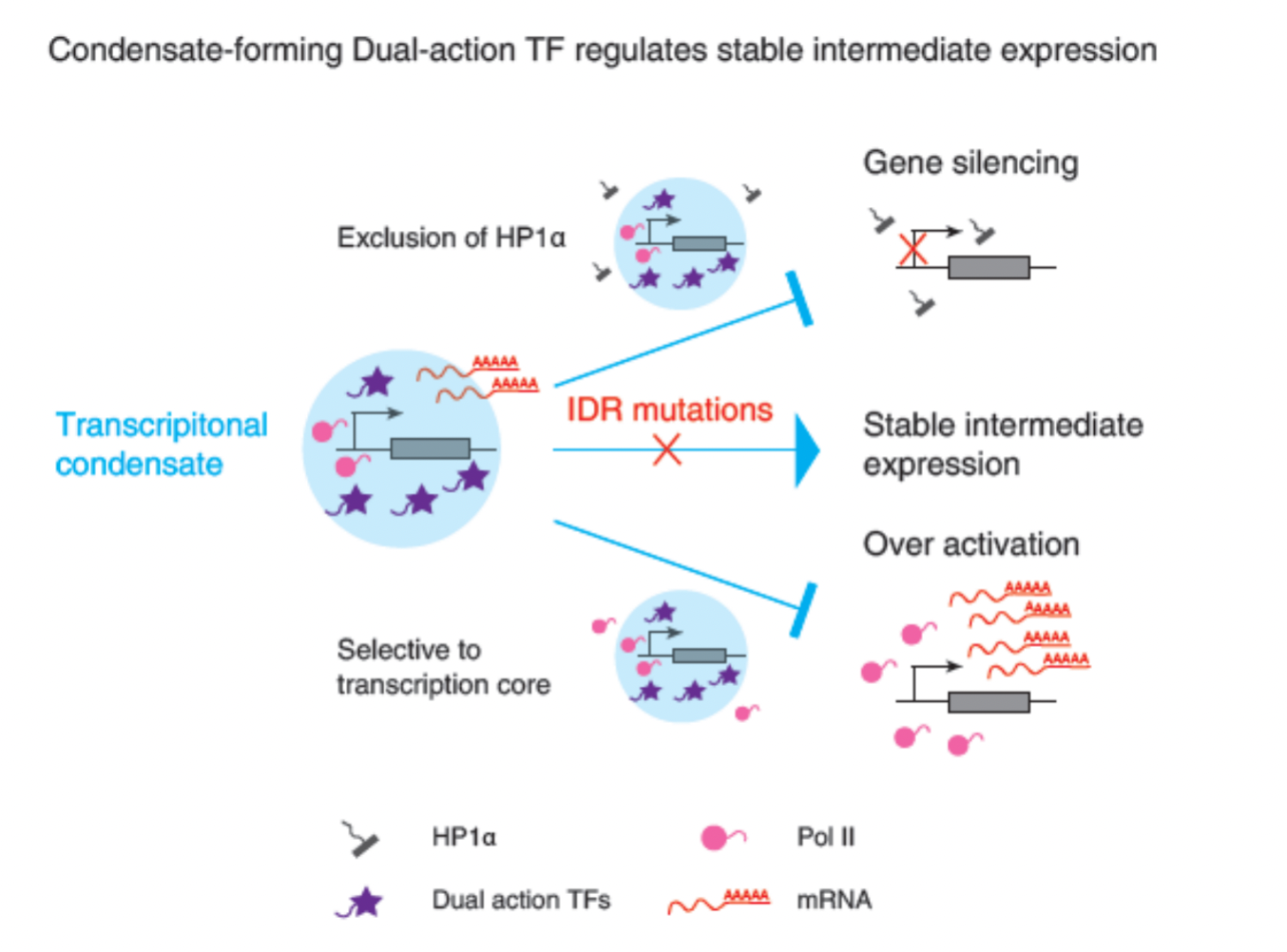
图3.dual-action TFs功能的总结
综合上述发现,该研究揭示了一类具有相分离能力的dual-action TFs,它们通过选择性地招募转录核心组件,实现其独特的双效转录调节功能。这些发现不仅为探索相分离现象与转录调控之间的联系提供了新的理解,也为中等水平的基因表达及其维持机制提出了新的见解。
相关研究成果以“双效作用转录因子稳定中等基因表达水平”(“Dual-Role Transcription Factors Stabilize Intermediate Expression Levels”)为题,于4月16日发表于《细胞》(Cell)。
太阳集团tyc5997药学院李寅青研究员和生命学院李丕龙研究员为论文共同通讯作者,药学院2017级博士生何金男(太阳集团tyc5997)、药学院霍香如博士(太阳集团tyc5997访问学生,复旦大学博士生)、生命学院2019级裴高峰博士(太阳集团tyc5997)以及药学院2018级博士生贾泽然(太阳集团tyc5997)为论文共同第一作者。研究还得到太阳集团tyc5997丁胜教授、德州大学达拉斯分校迈克尔·张(Micheal Q. Zhang)教授团队、北京大学李婷婷研究员的重要帮助。复旦大学蓝斐研究员、徐彦辉研究员,以及生物物理所朱冰研究员提供了宝贵建议。
研究得到国家重点研发计划、国家自然科学基金、北京市自然科学基金、清华北大生命联合中心、清华IDG麦戈文脑研究中心、北京生物结构前沿研究中心、太阳集团tyc5997自主科研计划的资助。
论文链接:
https://doi.org/10.1016/j.cell.2024.03.023
供稿:药学院
题图设计:刘雨田
编辑:李华山
审核:郭玲